La maladie de Parkinson
Cahier 2
Ordonnance
Auteur(s) : CAHIER COORDONNÉ PAR NATHALIE BELIN ET ALEXANDRA BLANC , PHARMACIENNES, SOUS LA RESPONSABILITÉ DE FLORENCE BONTEMPS , DIRECTRICE SCIENTIFIQUE
ANALYSE D’ORDONNANCE
J. L., 59 ANS, A L’IMPRESSION D’ALLER « AU RALENTI »
RÉCEPTION DE L’ORDONNANCE
POUR QUI ?
J. L., 59 ans.PAR QUEL MÉDECIN ?
Le neurologue qui a diagnostiqué la maladie.L’ORDONNANCE EST-ELLE CONFORME À LA RÉGLEMENTATION ?
Oui.QUEL EST LE CONdiv DE L’ORDONNANCE ?
QUE SAVEZ-VOUS DU PATIENT ?
J. L. est professeur de français au lycée. Sa maladie de Parkinson a été diagnostiquée il y a 2 ans alors qu’il souffrait d’un syndrome dépressif depuis plusieurs mois et de tremblements répétés au niveau de la main droite. Depuis, il est traité par rasagiline. J. L. poursuit son activité professionnelle et pratique la natation et le théâtre. Il fait partie d’une association de patients et anime un club de théâtre impliquant ses élèves et des patients parkinsoniens.QUEL ÉTAIT LE MOTIF DE LA CONSULTATION ?
J. L. a consulté son neurologue plus tôt que prévu car ses symptômes se sont aggravés : il tremble de plus en plus, surtout en fin de journée et a l’impression d’aller « au ralenti » dans la soirée lorsqu’il s’occupe de ses cours de théâtre, ce qui l’énerve au plus haut point et le décourage.QUE LUI A DIT LE MÉDECIN ?
Le médecin lui a expliqué qu’Azilect n’était plus suffisamment efficace. Il a décidé l’ajout d’un traitement (Ropinirole) qui renforcera l’effet thérapeutique et limitera la recrudescence des tremblements.Il a également prescrit des séances de kinésithérapie en expliquant qu’elles allaient aider à préserver la posture, la coordination des mouvements, la motricité et l’équilibre. Le médecin a également encouragé J. L. à poursuivre son activité de théâtre.
VÉRIFICATION DE L’HISTORIQUE
Les dispensations de rasagiline sont régulières. Forlax est parfois prescrit par le médecin généraliste.LA PRESCRIPTION EST-ELLE COHÉRENTE ?
QUE COMPORTE LA PRESCRIPTION ?
Rasagiline (Azilect) : il s’agit d’un inhibiteur de la monoamine oxydase de type B, enzyme responsable de la dégradation de la dopamine au niveau de l’espace synaptique. L’IMAO B contribue ainsi à augmenter la concentration en dopamine dont le déficit est à l’origine des symptômes moteurs de la maladie de Parkinson.Ropinirole (Requip) : c’est un agoniste dopaminergique qui agit en stimulant les récepteurs dopaminergiques post-synaptiques.
EST-ELLE CONFORME À LA STRATÉGIE THÉRAPEUTIQUE ?
Oui, chez un sujet jeune (avant 60 ou 65 ans généralement), lorsque les symptômes restent peu gênants, il est souvent proposé un IMAO B. Lorsque les symptômes deviennent plus gênants comme c’est le cas ici, un agoniste dopaminergique est souvent prescrit. L’objectif est de retarder l’introduction de lévodopa, le traitement de référence pour limiter les troubles moteurs, mais qui semble exposer plus précocement que les agonistes dopaminergiques à des complications (effets on-off).Y A-T-IL DES MÉDICAMENTS À MARGE THÉRAPEUTIQUE ÉTROITE ?
Non.Y A-T-IL DES CONTRE-INDICATIONS POUR CE PATIENT ?
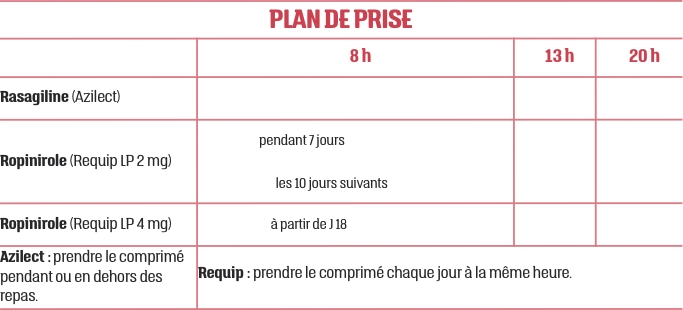
Non, le patient ne présente pas d’insuffisance rénale sévère ni d’insuffisance hépatique qui contre-indiquerait le ropinirole ou la rasagiline (celle-ci étant contre-indiquée en cas d'insuffisance hépatique sévère).LES POSOLOGIES SONT-ELLES COHÉRENTES ?
Oui. Pour Requip LP nouvellement prescrit, la posologie est de 2 mg par jour durant la première semaine puis la dose est augmentée à 4 mg une fois par jour à partir de la seconde semaine. Si besoin, le traitement peut être augmenté par paliers jusqu’à la dose maximale de 24 mg par jour.Y A-T-IL DES INTERACTIONS MÉDICAMENTEUSES ?
Non, l’ordonnance ne comporte pas d’interactions. En revanche, mieux vaut ne pas délivrer les traitements demandés par J. L. car ils peuvent interférer avec les traitements antidopaminergiques prescrits (voir encadré ci-dessus).LA PRESCRIPTION POSE- T-ELLE UN PROBLÈME PARTICULIER ?
Non.LE TRAITEMENT NÉCESSITE-T-IL UNE SURVEILLANCE BIOLOGIQUE PARTICULIÈRE ?
Non. La surveillance est d’ordre clinique.Q&DISCRETURN;UELS CONSEILS DE PRISE DONNER ?
CONCERNANT AZILECT
Il est important de rechercher et d’évoquer les éventuels effets indésirables que l’ajout de l’agoniste dopaminergique peut potentialiser.EFFETS INDÉSIRABLES
J. L. est depuis 2 ans sous rasagiline et supporte bien ce traitement. Il ne souffre ni de céphalées, vertiges ou hallucinations ni d’hypotension orthostatique qui peuvent survenir suite à la stimulation dopaminergique induite par la molécule. Il ne se plaint ni de nausées ni de vomissements, mais a parfois tendance à être constipé, d’où les prises de Forlax. La constipation peut être liée à l’évolution de la maladie, mais elle constitue aussi un effet indésirable fréquent des traitements antiparkinsoniens.OBSERVANCE
Elle semble correcte : les délivrances du médicament étant régulières. J. L. doit poursuivre les prises Azilect comme il en a l’habitude, en plus de la prise de l’agoniste dopaminergique.CONCERNANT REQUIP
Le ropinirole est un nouveau traitement pour J. L. : il est important de donner aux patients des conseils concernant la prise du médicament et de l’avertir de certains effets indésirables.UTILISATION
Le ropinirole s’administre pendant ou en dehors des repas, une fois par jour, à heure régulière avec un verre d’eau. Le comprimé à libération prolongée ne doit être ni mâché, ni écrasé, ni cassé, car cela peut entraîner un surdosage. Après la première semaine de traitement, J. L. peut prendre 2 comprimés LP à 2 mg pour finir la boîte. Il enchaînera avec le dosage LP à 4 mg ensuite.QUAND COMMENCER LE TRAITEMENT ?
Le patient peut prendre l’agoniste à libération prolongée en même temps que la prise d’Azilect le lendemain matin pour faciliter l’observance.QUE FAIRE EN CAS D’OUBLI ?
Un oubli de quelques heures peut être rattrapé. Si l’oubli dépasse 24 à 48 heures, le traitement doit être, le cas échéant, repris avec une posologie d’installation progressive.LE PATIENT POURRA-T-IL JUGER DE L’EFFICACITÉ DU TRAITEMENT ?
Oui, mais pas avant plusieurs jours, voire quelques semaines. Le point sera fait avec le médecin 2 mois plus tard.QUELS SONT LES PRINCIPAUX EFFETS INDÉSIRABLES ?
Le ropinirole provoque très fréquemment des troubles digestifs, surtout des nausées parfois des vomissements, une constipation ou un pyrosis. Le risque de somnolence et d’hypotension orthostatique, de vertiges et d’œdèmes périphériques est fréquent. Des épisodes d’hallucinations et de confusion peuvent aussi survenir, mais plutôt chez les patients âgés (cependant, ce type de symptômes peut également être une conséquence de la maladie elle-même). Comme tous les agonistes dopaminergiques, le ropinirole expose à des troubles du contrôle des impulsions (addiction aux jeux, hypersexualité, achats compulsifs, boulimie et compulsions alimentaires…).QUELS SONT CEUX GÉRABLES À L’OFFICINE ?
Les effets indésirables digestifs, la somnolence, les épisodes d’hypotension s’atténuent généralement après quelques jours. La prise du médicament durant les repas réduit les sensations de nausées. Si les nausées sont très gênantes, le patient doit avertir le médecin et surtout ne pas prendre d’antinauséeux en automédication (risque d’antagonisme avec les traitements dopaminergiques). En cas de reflux acide, la prise d’un topique antiacide à au moins 2 heures de distance des antiparkinsoniens est possible.Informer le patient et son entourage des risques liés aux troubles compulsifs, car le patient lui-même n’a généralement pas conscience de leur caractère pathologique.
QUELS SIGNES NÉCESSITENT D’APPELER LE MÉDECIN ?
Des épisodes d’hypotension gênants, des hallucinations, une somnolence importante ou l’apparition de troubles du contrôle des impulsions doivent être signalés afin d’adapter éventuellement les doses. Il faut aussi informer le médecin de l’évolution de la maladie comme l’a fait J. L. (réapparition des symptômes parkinsoniens : tremblements, lenteurs des mouvements, blocages).CONSEILS COMPLÉMENTAIRES
Rappeler au patient de privilégier une alimentation riche en fibres et de bien s’hydrater pour limiter la constipation.M. L. doit être vigilant, surtout les premiers temps, vis-à-vis du risque d’hypotension orthostatique favorisé par les 2 antiparkinsoniens (et par la maladie elle-même). Prudence particulièrement le matin au lever, en période post-prandiale ou durant les réveils nocturnes. Pour l’éviter, des mesures simples peuvent suffire : se lever progressivement, bien s’hydrater, avoir un apport suffisant en sel (en l’absence d’HTA ou d’insuffisance cardiaque), éviter l’exposition à la chaleur et, la nuit, surélever la tête de lit ; des chaussettes de compression peuvent être prescrites par le médecin.
qu’en pensez-vous ?
Pour soulager efficacement le rhume de J. L. vous lui proposez :
1) Actifed Rhume
2) Fervex Etat grippal
3) aucun de ces traitements
Réponse : l’association d’un IMAO B (rasagiline) à des sympathomimétiques comme les décongestionnants vasoconstricteurs nasaux ou oraux, ici la pseudoéphédrine dans Actifed Rhume, expose à un risque de poussées hypertensives. Cette association est déconseillée pour la rasagiline. Un antihistaminique H1 (phéniramine dans Fervex Etat grippal, tripolidine dans Actifed Rhume) peut induire une sédation. Mieux vaut ne pas l’associer aux traitements antiparkinsoniens qui, eux aussi, peuvent induire une somnolence. Un traitement local (solution d’hygiène nasale, gouttes nasales antiseptiques ou à base d’huiles essentielles, inhalation…) éventuellement associé à du paracétamol doit être privilégié chez ce patient. Il fallait donc choisir la réponse 3.
effet on-off
Passage en quelques secondes d’un état normal « on » à un état parkinsonien « off » caractérisé par une recrudescence majeure des troubles moteurs.
qu’en pensez-vous ?
Deux semaines après la délivrance de cette ordonnance, l’épouse de M. L. passe à la pharmacie. Son mari n’est plus enrhumé mais il est très fatigué par moments et s’endort parfois brusquement entre ses cours.
Quelle est votre réaction ?
1) Vous conseillez un complément vitaminique
2) Vous recherchez un effet iatrogène
3) Vous expliquez qu’il s’agit de l’évolution normale de la maladie
Réponse : une somnolence est fréquente sous agoniste dopaminergique mais ce dernier peut aussi provoquer un accès soudain de sommeil, très gênants et dangereux en cas de conduite automobile. Il peut être recommandé au patient de privilégier une prise le soir de Requip LP. Si cela ne suffit pas, l’inciter à contacter le médecin pour changer l’agoniste (le patient peut être moins sensible à une autre molécule). Il fallait donc choisir la deuxième proposition.
Physiopathologie de la maladie de Parkinson
- La maladie de Parkinson est due à la dégénérescence des neurones dopaminergiques de la substance noire (ou locus niger) qui jouent un rôle majeur dans le contrôle de la motricité, en particulier des activités spontanées, et de l'automatisme. S’y associe une dénervation d’autres systèmes de neurotransmetteurs : cholinergique, responsable des troubles cognitifs ; sérotoninergique, responsable de troubles de l'humeur ; noradrénergique.
- À l'autopsie, des inclusions éosinophiles, les corps de Lewy (agrégats de protéines), sont mises en évidence dans les cellules affectées par le processus dégénératif. Comme pour d'autres maladies dégénératives avec accumulation d’une protéine – ici l'alpha-synucléine – on ne sait si celle-ci est un marqueur ou si elle joue un rôle clef dans la pathogénie.
PATHOLOGIE
LA MALADIE DE PARKINSON EN 4 QUESTIONS
1 QUELS SONT LES SIGNES CLINIQUES ?
Les signes initiaux les plus fréquents sont représentés par la « triade parkinsonienne ».AKINÉSIE
L'akinésie (difficultés à l'initiation du mouvement), associée souvent à une bradykinésie (lenteur du mouvement) et une hypokinésie (diminution de l'amplitude du mouvement) qui conduit à une amimie (réduction des expressions du visage), une micrographie (écriture devenant petite et étroite), un balancement réduit du bras à la marche. Les mouvements alternatifs rapides deviennent difficiles à effectuer.HYPERTONIE
L’hypertonie ou rigidité se manifeste par une résistance à un mouvement passif. Elle cède par à-coups comme une roue dentée. Elle est à l’origine de déformations posturales et de douleurs.TREMBLEMENT
Absent dans 20 à 30 % des cas, il s'agit d'un tremblement de repos, majoré par le stress ou la fatigue. Il concerne souvent les mains, parfois le menton, la langue ou les membres inférieurs. La tête est habituellement épargnée. C’est un tremblement lent qui disparaît lors du mouvement.FORMES TROMPEUSES
Il existe des formes de début trompeuses : syndrome dépressif isolé, douleurs à l’épaule avec raideur, déficit de l’odorat, troubles du sommeil avec rêves animés. Ces symptômes peuvent précéder les troubles moteurs de plusieurs années.SIGNES NON MOTEURS
Ils apparaissent à des degrés variables au cours de l’évolution de la maladie et parfois dès le stade initial : apathie, dépression, douleurs pseudo-rhumatismales, paresthésies, troubles dysautonomiques (hypotension orthostatique, constipation, dysfonction érectile et troubles sphinctériens, sueurs, etc.).2 QUELLES SONT LES ÉTIOLOGIES ?
L’origine de la maladie semble être multifactorielle. Des facteurs génétiques et environnementaux sont identifiés.Environ 15 à 20 % des patients ont dans leur famille un parent atteint de la maladie de Parkinson. La liste des gènes incriminés ne cesse de s’allonger avec 24 facteurs de risque génétique dont la parkine et la découverte récente du gène VPS 13C qui code pour une protéine protectrice des neurones. La perte de fonction de cette protéine augmente la vulnérabilité des mitochondries au stress oxydatif participant à l’apaptose des neurones.
Ces formes génétiques se caractérisent par un début précoce de la maladie (avant 40-45 ans).
Parmi les facteurs environnementaux figurent des pesticides et solvants organiques, métaux lourds (cadmium, plomb, mercure) et le manganèse (métier de soudeur) : la prévalence de la maladie est plus importante dans les régions agricoles, viticoles et industrielles. La maladie de Parkinson est reconnue comme maladie professionnelle.
3 COMMENT EST PORTÉ LE DIAGNOSTIC ?
Une consultation neurologique est recommandée car le repérage des troubles moteurs est parfois difficile. Le diagnostic, essentiellement clinique, est suspecté devant une akinésie ou une bradykinésie ou une hypokinésie associée à au moins un des signes suivants : tremblement, rigidité ou instabilité posturale chez la personne âgée. Le tableau est parfois incomplet et dominé par un ou deux symptômes (forme tremblante, forme akinéto-hypertonique).L’installation progressive des signes et leur caractère unilatéral au début de la maladie et asymétrique confortent le diagnostic de même que la bonne réponse à la dopathérapie.
L’exclusion d’autres causes de syndrome parkinsonien est indispensable.
Aucun examen complémentaire n’est nécessaire, sauf en cas de tableau atypique faisant suspecter une autre maladie dégénérative ou en cas de réponse partielle à la L-dopa : IRM cérébrale, DAT-scan, enregistrement des mouvements oculaires.
4 QUELLE EST L’ÉVOLUTION ?
La vitesse de progression de la maladie est très variable d’un patient à l’autre : chez certains, elle est lente avec une gêne limitée durant de nombreuses années ; chez d’autres, les complications motrices surviennent précocement.Lorsque les premiers symptômes moteurs apparaissent, environ la moitié des neurones dopaminergiques a disparu. La substitution dopaminergique permet alors de contrôler la maladie durant quelques années (5 à 10 ans) : c’est la « lune de miel ». Mais, même à ce stade, la maladie peut parfois s’aggraver au décours d’une infection par exemple.
Dans un deuxième temps, des complications apparaissent, liées à l’évolution de la maladie ou au traitement lui-même :
- des fluctuations motrices caractérisées par la résurgence des signes parkinsoniens (akinésie de fin de dose ou nocturne, effets on/off…) et traduisant des fluctuations d’activité du traitement, ou des fluctuations non motrices (troubles dysautonomiques à type de douleurs abdominales, dysphagie, mictions impérieuses, sueurs, douleurs, paresthésies, épisodes dépressifs) ;
- des dyskinésies (mouvements anormaux involontaires et incontrôlés) induites par la lévodopa et affectant surtout des patients débutant leur maladie assez jeune (avant 60 ans).
Enfin, progressivement apparaissent d’autres symptômes liés aux lésions non dopaminergiques et qui signent le déclin moteur et cognitif du patient : troubles de la marche (freezing ou blocage au démarrage ou devant un obstacle ou lors d’un demi-tour ; festination), troubles de la posture (attitude générale en flexion, dos courbé et tête penchée en avant, à l’origine de troubles de l’équilibre et de chutes), troubles de la parole et de la déglutition occasionnant des fausses routes, déficits cognitifs pouvant évoluer vers une démence. Les troubles du sommeil, la dépression, l’apathie et l’anxiété sont également fréquents. Le traitement dopaminergique peut aussi être à l’origine d’hallucinations, voire de délires.
en chiffres
Environ 150 000 patients en France.
Prévalence moyenne : 827, 5 cas pour 100 000. Augmente avec l'âge.
Âge moyen d'apparition de la maladie : 58 ans. 10 % des patients ont moins de 50 ans. Il existe des formes génétiques rares qui se manifestent plus tôt, avant l'âge de 40-45 ans.
Légère prédominance masculine, moins fréquente chez les sujets asiatiques et africains.
DAT-Scan
Scintigraphie cérébrale utilisant un radiotraceur ligand du transporteur de la dopamine, injecté par voie IV permettant de visualiser la dénervation dopaminergique présynaptique.
Maladie de Wilson
Maladie familiale autosomique récessive associée à une accumulation de cuivre à l’origine de lésions du système nerveux et du foie.
Effets on/off
Passage en quelques secondes d’un état normal « on » à un état parkinsonien, « off », caractérisé par une recrudescence majeure des troubles moteurs.
Festination
Brusque augmentation de la fréquence de la marche.
Diagnostics différentiels
• Syndrome parkinsonien iatrogène : c’est le principal diagnostic différentiel. Les médicaments responsables sont essentiellement les neuroleptiques (typiques, atypiques ou « cachés » type métoclopramide, buspirone, flunarizine, etc.) et plus rarement des molécules à action antidopaminergique (certains inhibiteurs calciques, valproate de sodium, lithium, etc.).
• Autres syndromes parkinsoniens dégénératifs : les symptômes sont proches de ceux de la maladie de Parkinson, mais il existe en plus des signes neurologiques atypiques (chute précoce, démence précoce, syndrome dysautomique précoce, etc.). De plus, ils répondent peu ou mal au traitement dopaminergique. C’est le cas par exemple, de la démence à corps de Lewy où la symptomatologie parkinsonienne s’associe précocement à une démence avec hallucinations.
• Syndromes parkinsoniens secondaires. Ils sont dus à des causes diverses :maladie de Wilson, syndromes parkinsoniens vasculaires (liés à des lésions vasculaires multiples touchant les noyaux gris centraux), tumeur…
• Ce qui n’est pas un syndrome parkinsonien : en particulier, le tremblement essentiel qui se caractérise par un tremblement d’attitude et d’action, et non de repos. Il touche l’extrémité distale des membres supérieurs, parfois la tête et la voix (timbre chevrotant).
THÉRAPEUTIQUE
COMMENT TRAITER LA MALADIE DE PARKINSON ?
STRATÉGIE THÉRAPEUTIQUE
La prise en charge, globale et multidisciplinaire, vise à améliorer les symptômes moteurs et non moteurs, et ainsi la qualité de vie du patient.La stratégie thérapeutique dépend à la fois de l’âge du patient, de la gêne fonctionnelle et des effets indésirables à court et long termes des molécules.
La kinésithérapie occupe une place importante dès le début de la maladie, de même que les exercices d’orthophonie (voir p. 14). L’exercice physique est recommandé.
PAS OU PEU DE GÊNE FONCTIONNELLE
Lorsque les symptômes moteurs sont minimes, un inhibiteur de la monoamine-oxydase B (IMAO B) peut être proposé. Des études suggèrent notamment une action neuroprotectrice de la rasagiline et l’intérêt de l’initier précocement. En cas d’échec ou d’efficacité insuffisante de l’IMAO B, il peut être remplacé par un agoniste dopaminergique.L’amantadine ou les anticholinergiques (bipéridène, tropatépine…) sont éventuellement proposés dans les formes à tremblement prédominant chez les sujets jeunes. Les effets indésirables des anticholinergiques limitent leur utilisation chez les personnes âgées.
GÊNE FONCTIONNELLE MARQUÉE
La lévodopa est le traitement de référence le plus efficace pour réduire les troubles moteurs. Elle induit moins de troubles cognitifs ou psychiatriques que les agonistes dopaminergiques (confusions, délires, troubles compulsifs, troubles du sommeil…) et de ce fait, elle est préconisée en première intention chez les sujets âgés (plus de 65/70 ans).Chez les sujets jeunes (avant 60/65 ans), les agonistes dopaminergiques sont préférés pour retarder l’instauration de la lévodopa qui semble exposer plus précocement à des complications motrices. Après quelques années, en fonction de l’efficacité, du handicap moteur ou d’éventuels effets indésirables, ils sont diminués si besoin et associés à la lévodopa.
Les traitements sont instaurés à dose progressive et ne doivent pas être interrompus brutalement au risque d’apparition d’un syndrome malin des neuroleptiques. En cas de nausées, fréquentes en début de traitement ou lors des augmentations de posologie, seule la dompéridone (antagoniste dopaminergique ne passant pas la barrière hématoencéphalique) est utilisable sur une courte durée (voir encadré « Ce qui a changé »).
AU STADE DES COMPLICATIONS MOTRICES
L’objectif est de lutter contre les fluctuations d’activité (akinésie de fin de dose, effets on/off) et les dyskinésies, en ayant une stimulation dopaminergique la plus régulière possible à dose minimale efficace à chaque prise. Plusieurs options sont possibles.Sous lévodopa : fractionnement des doses, adaptation des horaires de prise (prise à distance des repas pour une meilleure biodisponibilité) ; ajout d’un agoniste ou d’un inhibiteur de la catéchol-O-méthyl-transférase (ICOMT) ou d’un IMAO B ; utilisation de formes à libération prolongée notamment le soir en cas d’akinésie nocturne ou au réveil, ou au contraire à une forme dispersible dont le délai d’action est plus court, etc.
Sous agoniste dopaminergique : fractionnement des doses, augmentation de la posologie en cas de bonne tolérance, association à la lévodopa.
En cas de blocages sévères, l’apomorphine en injection sous-cutanée permet de faire passer un patient de la phase « off » à la phase « on » en quelques minutes. Si cela ne suffit pas, une pompe à apomorphine permettant une délivrance en continu avec possibilité de bolus (mise en place à l’hôpital) est une option.
En cas d’échec de ces traitements, la stimulation cérébrale profonde voire le traitement par Duodopa à l’hôpital sont envisagés. La stimulation cérébrale profonde consiste en l’implantation d’électrodes permettant une stimulation électrique continue dans les noyaux subthalamiques. Duodopa (association de lévodopa et carbidopa) est administrée par sonde duodénale mise en place lors d’une gastrostomie.
TROUBLES NON MOTEURS
Liés à la maladie elle-même ou aux traitements, leur prise en charge est essentielle. Constipation : règles hygiénodiététiques, laxatifs doux. Troubles urinaires : anticholinergiques (chlorure de trospium, toltérodine…), alphabloquant (alfuzosine…). Hypotension orthostatique : règles hygiénodiététiques, contention de classe 2 au moins, traitement symptomatique (midodrine…). Dépression : ISRS, IRSNA sauf sous IMAO B où il faut préférer d’autres molécules en évitant les tricycliques du fait de leurs effets indésirables.Troubles psychotiques (délire, hallucinations, confusion…) : les traitements parkinsoniens les plus pourvoyeurs de ces effets indésirables (anticholinergiques puis amantadine, puis agonistes dopaminergiques puis IMAO B et ICOMT) sont diminués ; les neuroleptiques antipsychotiques sont déconseillés (risque d’aggravation des symptômes par antagonisme réciproque) à l’exception de la clozapine.
Celle-ci est la seule molécule à avoir une AMM spécifique dans le traitement des troubles psychotiques survenant au cours de la maladie de Parkinson. Le risque d’agranulocytose implique une surveillance de la NFS une fois par semaine les 18 premières semaines puis une fois par mois. Prescription initiale hospitalière annuelle réservée aux psychiatres, gériatres et neurologues.
Douleurs : antalgiques classiques et/ou utilisés dans les douleurs neuropathiques, kinésithérapie.
TRAITEMENTS
LÉVODOPA
C’est le traitement le plus efficace et le mieux toléré. La lévodopa est systématiquement associée à un inhibiteur périphérique de la décarboxylase (bensérazide, carbidopa) qui évite sa dégradation en dopamine avant qu’elle ne traverse la barrière hématoencéphalique.Effets indésirables : nausées, vomissements, surtout à l’instauration du traitement ou lors de l’augmentation des doses, hypotension orthostatique, rares troubles du rythme cardiaque, constipation, coloration brun-noir des urines. Au niveau central, la lévodopa peut entraîner une somnolence ou au contraire une agitation, des accès de sommeil ainsi que des troubles du comportement, même s’ils sont moins fréquents qu’avec les agonistes dopaminergiques. Avec le temps, diminution de son efficacité et apparition de fluctuations motrices et de dyskinésies.
Interactions : association contre-indiquée avec les neuroleptiques antiémétiques ; déconseillée avec les sels de fer qui sont à prendre au minimum 2 heures après ou avant la prise de lévodopa.
AGONISTES DOPAMINERGIQUES
On distingue ceux à noyau ergoté (bromocriptine) et ceux à noyau non ergoté, (apomorphine, piribédil, pramipexole, ropinirole, rotigotine). Ces derniers, plus récents et n’exposant ni à un risque de fibrose pleuropulmonaire ou rétropéritonéale ni à des valvulopathies cardiaques (contrairement aux dérivés ergotés), sont préférés. L’amantadine, un agoniste dopaminergique faible, est peu efficace sur les troubles moteurs ; elle est parfois utilisée au début de la maladie dans les formes tremblantes ou pour réduire la sévérité des dyskinésies. Le piribédil (Trivastal) d’efficacité modérée est peu utilisé. La rotigotine, par voie transdermique, est notamment utile en cas de troubles de la déglutition.Effets indésirables : sensiblement les mêmes que sous lévodopa, mais d’intensité différente. En raison d’une demi-vie plus longue, ils entraînent moins de dyskinésies. En revanche, les troubles du contrôle des impulsions (jeu pathologique, pulsions d’achat, hypersexualité), les troubles digestifs, et la somnolence sont plus marqués. Ils sont aussi à l’origine d’œdèmes des membres inférieurs. L’amantadine a des effets anticholinergiques (rétention urinaire).
Interactions. Association contre-indiquée avec les neuroleptiques antiémétiques. Associations déconseillées nombreuses avec la bromocriptine : alcaloïdes de l’ergot de seigle vasoconstricteurs (dihydroergotamine, ergotamine…), sympathomimétiques (risque de vasoconstriction et/ou de poussées hypertensives) ; macrolides (sauf spiramycine : augmentation des concentrations en bromocriptine).
ICOMT
L’entacapone ou la tolcapone sont indiqués en association à la lévodopa au stade des fluctuations motrices pour en améliorer l’efficacité.En raison d’un risque rare mais grave d’insuffisance hépatique aiguë et de syndrome malin des neuroleptiques, la tolcapone n’est indiquée qu’en cas d’échec ou d’intolérance à l’entacapone. Sa prescription, réservée aux neurologues, implique une surveillance régulière de la fonction hépatique.
Effets indésirables communs : principalement troubles digestifs (nausées, vomissements), troubles du transit (diarrhées pouvant nécessiter l’arrêt du traitement) ; coloration des urines en brun rouge pour l’entacapone et en jaune intense pour la tolcapone.
Interactions. Association contre-indiquée avec les neuroleptiques antiémétiques, les IMAO non sélectifs (iproniazide) et les IMAO A (moclobémide). Les sels de fer sont à prendre à 2 heures de distance de l’entacapone.
IMAO B
La rasagiline et la sélégiline sont le plus souvent indiquées seules au stade précoce de la maladie, ou en association à la lévodopa au stade des fluctuations motrices.
Effets indésirables : céphalées troubles digestifs, hypotensions, troubles neuropsychiques (confusion).
Interactions. Association contre-indiquée avec les neuroleptiques antiémétiques, les autres IMAO, les triptans métabolisés par la MAO, le millepertuis… (voir tableau page 10). Association déconseillée ou contre-indiquée pour la sélégiline avec les ISRS, les IRSNA (risque de syndrome sérotoninergique), les tricycliques, les sympathomimétiques. Association déconseillée avec le tramadol, le dextrométhorphane, les triptans.
ANTICHOLINERGIQUES
Les anticholinergiques, bipéridène (Akineton LP), trihexyphénidyle (Artane, Parkinane), tropatépine (Lepticur) sont peu utilisés en raison de leurs effets indésirables gênants chez les patients âgés : constipation, sécheresse buccale, rétention urinaire, confusions, hallucinations, troubles de la mémoire…Interactions : médicaments à effets atropiniques (tricycliques, antiH1, etc.).
PERSPECTIVES THÉRAPEUTIQUES
Le CVXL-0107, un inhibiteur de relargage du glutamate, est en cours d’études de phase II chez les patients à un stade avancé avec des fluctuations motrices et des dyskinésies.La défériprone, molécule chélatrice du fer, à l'étude, semble ralentir la progression de la maladie.
L'opicapone, un ICOMT ayant une sélectivité périphérique élevée est étudié chez les patients atteints de fluctuations motrices.
CE QUI A CHANGÉ
• Arrêt de commercialisation. Lisuride (Dopergine, en 2013) et pergolide (Celance, en 2011), des agonistes dopaminergiques ergotés, en raison de risque de fibroses pleuropulmonaires et cardiaques ; Otrasel en 2015 (sélégiline en lyophilisat oral).
• Dompéridone : l’ANSM a émis des restrictions d’utilisation en 2014. En raison de risques cardiaques rares mais graves (torsades de pointe), elle doit être utilisée à la dose efficace la plus faible pour une période la plus courte possible.
Syndrome malin des neuro-leptiques
Menaçant le pronostic vital, il associe des troubles de la conscience, une rigidité musculaire généralisée, une hyperthermie, une tachycardie et une hypotension artérielle. À suspecter chez un patient parkinsonien fébrile devant une aggravation des symptômes.
Syndrome séroto- ninergique
Lié à l’association de 2 médicaments ayant chacun des propriétés sérotoninergiques, il peut entraîner confusion, agitation, myoclonies, sudation, frissons, tremblements, hyperthermie, diarrhée.
vigilance !!!
Les principales contre-indications des traitements sont :
• Lévodopa : psychoses graves, confusion mentale, accidents cardiaques avec angor et troubles du rythme récents, glaucome à angle fermé
• Ropinirole : insuffisance rénale sévère
• Rotigotine : IRM, cardioversion électrique (retirer le patch)
• Bromocriptine : troubles psychiques sévères ou antécédents, valvulopathie, facteurs de risque vasculaires, artériopathie périphérique, insuffisance coronaire
• Apomorphine : troubles psychiatriques, dépression respiratoire
• Entacapone, tolcapone : antécédent de syndrome malin des neuroleptiques et/ou de rhabdomyolyse ; dyskinésies sévères pour la tolcapone
• Sélégiline : ulcère duodénal ou gastrique en évolution
Pointdevue
Pr Philippe Damier, service de neurologie, CHU de Nantes
La stimulation cérébrale profonde est efficace plusieurs années sur les troubles moteurs et les dyskinésies
À qui s’adresse la stimulation cérébrale profonde ?
La chirurgie la plus courante est l’implantation des électrodes au niveau des noyaux subthalamiques. Elle est réservée à des patients plutôt jeunes qui ont plusieurs années d’évolution de la maladie et sont toujours bon répondeurs à la lévodopa, sans troubles cognitifs ou psychiatriques importants mais chez qui les complications motrices apparaissent. Elle permet de réduire de façon conséquente le traitement médicamenteux et les dyskinésies pendant plusieurs années. Mais elle n’empêche pas la maladie de progresser et est sans effets sur les signes non dopaminergiques (troubles de l’équilibre ou déficit cognitif). D’autres cibles chirurgicales sont possibles, envisageables aussi chez des patients plus âgés, comme le pallidum interne chez ceux qui ont des mouvements anormaux sévères ou le thalamus en cas de formes tremblantes.
Comment gérer les nausées et la prise de dompéridone ?
La prescription de dompéridone n’est plus systématique en raison du risque cardiovasculaire lié à ce médicament. Elle reste indispensable quand on initie un traitement par apomorphine qui entraîne beaucoup de nausées. Ensuite, ce sont les agonistes qui sont le plus à risque, puis la lévodopa. Le plus souvent, les nausées régressent au bout de quelques jours, voire quelques semaines. Si la dompéridone est nécessaire, le patient ne doit la prendre que le temps approprié.
ACCOMPAGNER LE PATIENT
CORINE, 58 ANS, SECRÉTAIRE EN RETRAITE ANTICIPÉE
LA MALADIE VUE PAR LES PATIENTS
IMPACT PSYCHOLOGIQUE
Troubles de l’humeur, insomnie et fatigue sont très fréquents. La proportion de patients traités pour une dépression est élevée. Celle-ci peut être liée à la maladie elle-même et peut précéder l’apparition des troubles moteurs, ou peut être due à l’annonce du diagnostic et à la dépendance qu’entraîne la maladie.IMPACT SUR LE QUOTIDIEN
La lenteur des mouvements nécessite d’anticiper la toilette, l’habillage, les déplacements, la prise des repas. Des signes non dopaminergiques s’ajoutent aux troubles moteurs : hypotension orthostatique, troubles urinaires, constipation, hypersialorrhée… Il ne faut pas hésiter à faire appel aux aides à domiciles (aide ménagère, aide-soignant…). Se faire reconnaître comme personne handicapée auprès des Maisons départementales des personnes handicapées (MDPH) peut permettre l’accès à plusieurs aides financières.Impact sur la vie familiale.
L’entourage est confronté aux symptômes, à la perte d’autonomie et aux troubles du comportement ou psychiatriques : dépression, agressivité, anxiété, apathie (diminution de la motivation, manque de prise d’initiatives…). Les troubles de la sexualité sont également très fréquents (baisse de la libido, troubles de l’érection, sécheresse vaginale…).
IMPACT PROFESSIONNEL
Psychologiquement et physiquement, la poursuite du travail nécessite des adaptations.La perte de l’emploi ou la mise en invalidité a pour immédiate conséquence une perte financière, puis une perte de revenus, lors de la retraite.
À DIRE AU PATIENT
À PROPOS DE LA MALADIE
Optimiser le suivi : les consultations médicales doivent être régulières, y compris chez le neurologue (au moins tous les 6 mois). Le patient ou l’entourage doit noter les moments de survenue des symptômes, des complications motrices, et le cas échéant les circonstances qui ont pu les favoriser (stress, infection…). Troubles de l’humeur, du sommeil, troubles psychotiques (hallucinations…), transpiration excessive (fréquente en fin de dose « off » ou parfois en période « on »), œdèmes périphériques doivent être signalés au médecin pour une prise en charge adaptée.Entretenir et améliorer la motricité : les exercices de kinésithérapie (équilibre, posture, renforcement musculaire, adresse motrice…) jouent un rôle important et sont recommandés dès l’annonce du diagnostic. En complément, la pratique d’une activité physique régulière adaptée (marche, vélo, natation, jardinage, yoga, danse…) est bénéfique. Elle entretient le moral, la tonicité, la souplesse articulaire, a un rôle bénéfique sur les douleurs associées à la maladie, et oblige le patient à exercer sa motricité.
Rééducation orthophonique : elle prévient ou corrige les troubles de la parole, de la déglutition, mais aussi les troubles de l’écriture (micrographie), la diminution de l’expression faciale.
Alimentation : elle doit être équilibrée, nourrissante pour limiter la perte de poids (fréquente), suffisamment riche en fibres et associée à une bonne hydratation pour lutter contre la constipation. Pour réduire les troubles de la déglutition, manger en se tenant droit, prendre de petites bouchées et les mâcher lentement. Des eaux gélifiées peuvent aider à assurer l’hydratation.
Aménager le domicile : l’ergothérapeute apporte de nombreux conseils : suppression des tapis, barre d’appui de douche, rehausseur de WC, couverts ergonomiques, regroupement des ustensiles de cuisine, adaptation des différents objets de la vie courante – brosse à dents électrique, habits plus amples à fermeture éclair ou gros boutons, chaussures sans lacets…
À PROPOS DES TRAITEMENTS
Moment de prise : bien respecter les moments de prises pour éviter les fluctuations d’activité. Des applications d’aide à l’observance peuvent être utiles (Medi’Rappel, Medissimo, Medisafe, Mon Pilulier…). Ne jamais interrompre brutalement le traitement au risque de voir apparaître une akinésie aiguë ou un syndrome malin des neuroleptiques. Ce dernier est à évoquer lors de manifestation de troubles chez un patient fiévreux.Adapter son rythme de vie : par exemple prendre le traitement dès le réveil et attendre le début de ses effets pour se lever et débuter une activité (sorties, courses…) ; à l’inverse prévoir des activités reposantes en fin de doses.
Effets indésirables.Diarrhée : sous entacapone et tolcapone, elle nécessite de mettre en place les mesures diététiques classiques (boisson abondante, régime pauvre en fibres) et de surveiller le poids. Une diarrhée persistante impose l’arrêt du traitement. Atteinte hépatique : sous tolcapone, tout signe évocateur doit être rapidement signalé au médecin (nausées persistantes, fatigue, anorexie, ictère, urines foncées, sensibilité de l’hypochondre droit). Somnolence, accès de sommeil : sous lévodopa et surtout sous agonistes dopaminergiques, ils nécessitent une mise en garde systématique. Troubles compulsifs (addiction au jeu, à Internet ou achats pathologiques, troubles du comportement alimentaire, hypersexualité, activités répétitives) : sensibiliser l’entourage à leur survenue sous lévodopa et surtout agonistes. Ils peuvent nécessiter de diminuer voire de stopper les agonistes et d’optimiser les prises de L-dopa.
Interactions : attention aux antiémétiques qui antagonisent l’effet des antiparkinsoniens (métoclopramide, métopimazine…).Seule la dompéridone qui ne passe pas la barrière hémato-encéphalique peut être utilisée. L'alcool et les traitements sédatifs ou antihypertenseurs peuvent majorer la somnolence et l’hypotension induite par les antiparkinsoniens. Nombreuses interactions avec les IMAO B (ISRS, pseudo-éphédrine, tramadol, dextrométorphane…). En cas de traitement par lévodopa, il peut être proposé de dissocier sa prise de celle des aliments riches en protéine car ces derniers peuvent perturber son absorption.
question de patient Mon mari se plaint de sécheresse buccale pourtant il présente souvent une hypersalivation ...
«Paradoxalement à l’hypersalivation, due plutôt à une diminution du réflexe de déglutition, les patients présentent souvent une sécheresse buccale qui favorise l’apparition de caries. Pour rendre la situation plus confortable, il peut sucer des bonbons sans sucre, recourir à des substituts salivaires (Artisial, Aequasyal…). Pour anticiper les problèmes buccodentaires, des contrôles réguliers chez le dentiste sont recommandés »
EN SAVOIR PLUS
France Parkinson
franceparkinson.fr Soutiens, conseils et informations pour les patients
Haute Autorité de santé
has-sante.fr « Guide du parcours de soins Maladie de Parkinson », juin 2014
DÉLIVRERIEZ-VOUS CES ORDONNANCES ?
MÉMO DÉLIVRANCE
Administration : de préférence au cours d’un repas en cas de nausées. Une prise, 30 minutes à 1 heure avant un repas est néanmoins préférable pour la L-dopa afin d’améliorer sa biodisponibilité.
Bien respecter les horaires de prise pour limiter les fluctuations d’activité.
Ne jamais interrompre brutalement le traitement (risque d’apparition d’un syndrome malin des neuroleptiques).
Est-il sensibilisé aux effets indésirables ?
Certains sont aussi liés à la maladie elle-même.
Nausées : surtout à l’initiation du traitement et lors de l’augmentation des doses. Seule la dompéridone qui ne passe pas la barrière hémato-encéphalique peut être utilisée à la dose la plus faible possible et sur la durée la plus courte possible (métoclopramide, métopimazine, alizapride, antagonisent l’effet des antiparkinsoniens).
Hypotension orthostatique : recommander le port de bas de contention, un lever progressif, l’apport suffisant de sel (en l’absence d’HTA ou d’insuffisance cardiaque) et de boissons.
Constipation : conseiller une hydratation suffisante et une alimentation riche en fibres. Les laxatifs doux au long cours sont souvent nécessaires.
Somnolence : attention aux accès soudain de sommeil, notamment sous agonistes dopaminergiques.
Troubles compulsifs (jeux pathologiques, achats compulsifs, hypersexualité, boulimie…) surtout sous agonistes, mais aussi sous L-dopa : sensibiliser l’entourage au risque d’apparition de ces troubles. En avertir le médecin pour ajuster le traitement, voire l’arrêter.
Complications motrices (réapparition des symptômes parkinsoniens : blocage à l’exécution des mouvements, rigidité, lenteur…) et dyskinésies (mouvements anormaux involontaires) doivent être rapportées avec précision (à quels moments de la journée) au médecin, et ainsi adapter le traitement. Le patient doit aussi noter les circonstances qui ont pu favoriser leur apparition (stress, infection…).
Troubles psychotiques (délire, hallucinations, confusion…) : les traitements parkinsoniens les plus pourvoyeurs de ces effets indésirables (anticholinergiques puis amantadine, puis agonistes dopaminergiques puis IMAO B et ICOMT) sont diminués. La clozapine est le seul antipsychotique utilisable.
Y a-t-il des coprescriptions ou le patient a-t-il l’habitude de s’automédiquer ?
Les antihypertenseurs et les médicaments dépresseurs du système nerveux central peuvent potentialiser l’hypotension orthostatique et la somnolence.
Attention aux nombreuses interactions sous IMAO B (risque notamment de syndrome sérotoninergique ou de crise hypertensive) : millepertuis, vasoconstricteurs (pseudo-éphédrine), dextrométhorphane, tramadol, triptans, IRS et IRSNA…
non Il ne faut pas délivrer l’antidépresseur. Les ISRS (fluoxétine) et les IRSNA doivent être évités chez les patients sous IMAO B comme la rasagiline (Azilect) : cette association, déconseillée avec la fluoxétine, expose en effet, au risque d’apparition d’un syndrome sérotoninergique. Il est préférable d’appeler le médecin et de lui proposer l’utilisation d’un autre antidépresseur : agomélatine, miansérine, mirtazapine.
oui mais en expliquant qu'il ne faut, en aucun cas, remplacer Stalevo 100 mg par 2 comprimés de Stalevo à 50 mg. En effet, la dose unitaire d’entacapone (200 mg) serait alors doublée (400 mg). Or, elle ne doit pas dépasser 200 mg par prise. Concernant Leponex, vérifier que l’ordonnance mentionne bien la réalisation d’une numération leucocytaire avec résultat dans les limites de la normale. La molécule expose à un risque d’agranulocytose, d’où une surveillance stricte hebdomadaire, pendant les 18 premières semaines de traitement, puis une surveillance mensuelle.
Vous sentez-vous régulièrement en insécurité dans vos officines ?
1Healthformation propose un catalogue de formations en e-learning sur une quinzaine de thématiques liées à la pratique officinale. Certains modules permettent de valider l'obligation de DPC.
Vous avez des questions ?
Des experts vous répondent !